Impfstoffstudie
Es grenzt nahezu an ein Wunder, dass innerhalb von sechs Monaten nach Ausbruch der COVID-19-Pandemie bereits erste Daten einer Impfstoffstudie veröffentlicht wurden. Diese basieren auf einer Phase-I-, also Dosisfindungsstudie und müssen daher mit Zurückhaltung interpretiert werden.
Wir hatten in einem früheren Newsletter bereits den Start einer Phase-I-Impfstoff-Studie in den USA behandelt. Phase-I-Studien dienen in der Arzneimittelentwicklung v.a. der Findung der geeigneten Dosis, Verträglichkeit und Sicherheit eines Medikaments im Menschen. Hierfür werden üblicherweise gesunde Freiwillige rekrutiert, die unter strengsten Sicherheitsauflagen verschiedene Dosierungen einer Substanz verabreicht bekommen.
Die mRNA-1273 Studiengruppe setzt sich aus Forscherinnen und Forschern des Kaiser Permanente Washington Health Research Institute in Seattle und der Emory University School of Medicine in Atlanta zusammen. Das Projekt wird u.a. durch das National Institute of Allergy and Infectious Diseases (NIAID) und dem Hersteller, der Firma Moderna (Cambridge, MA), finanziert.
Die Ergebnisse der Phase-I-Studie wurden nun im New England Journal of Medicine publiziert.
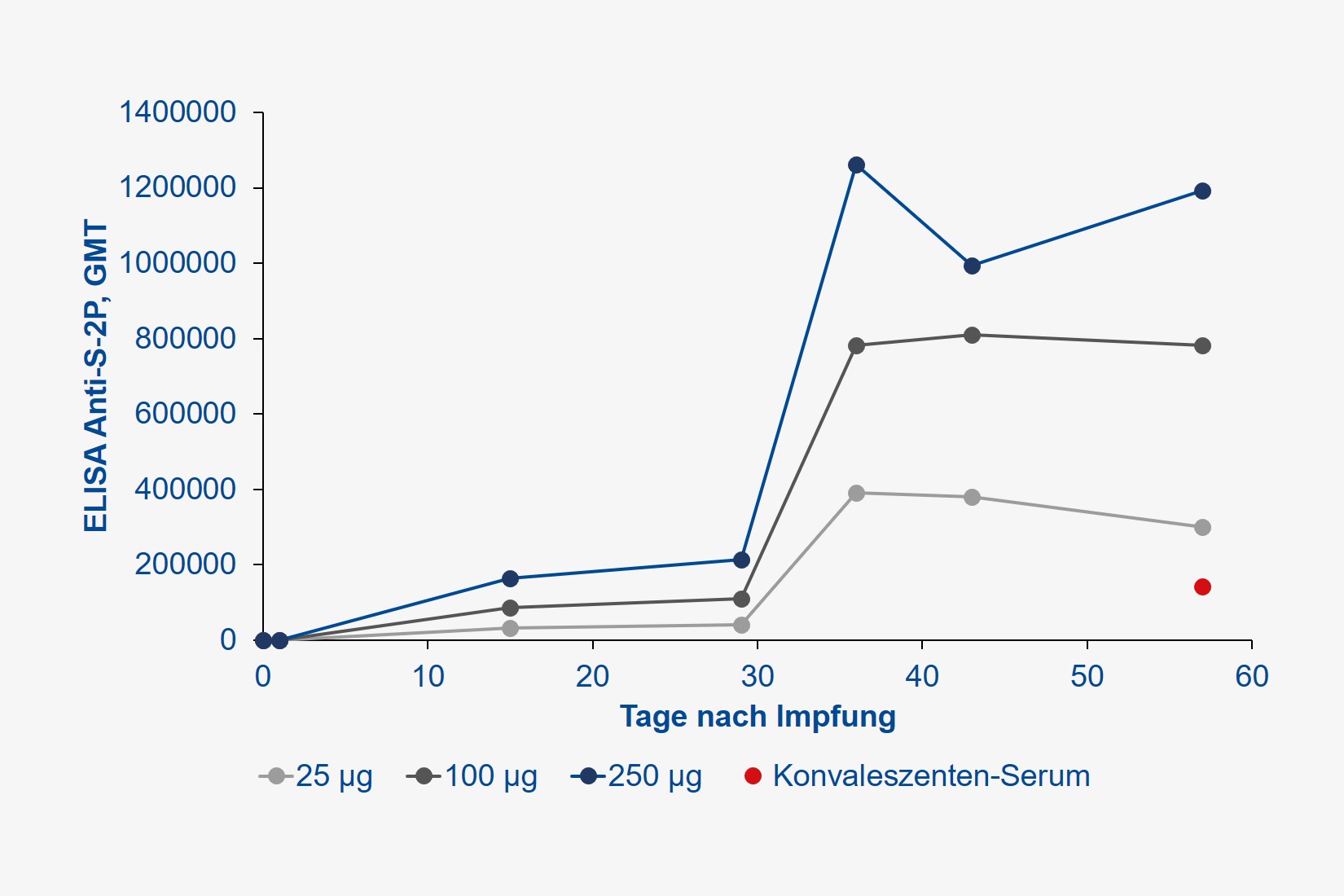
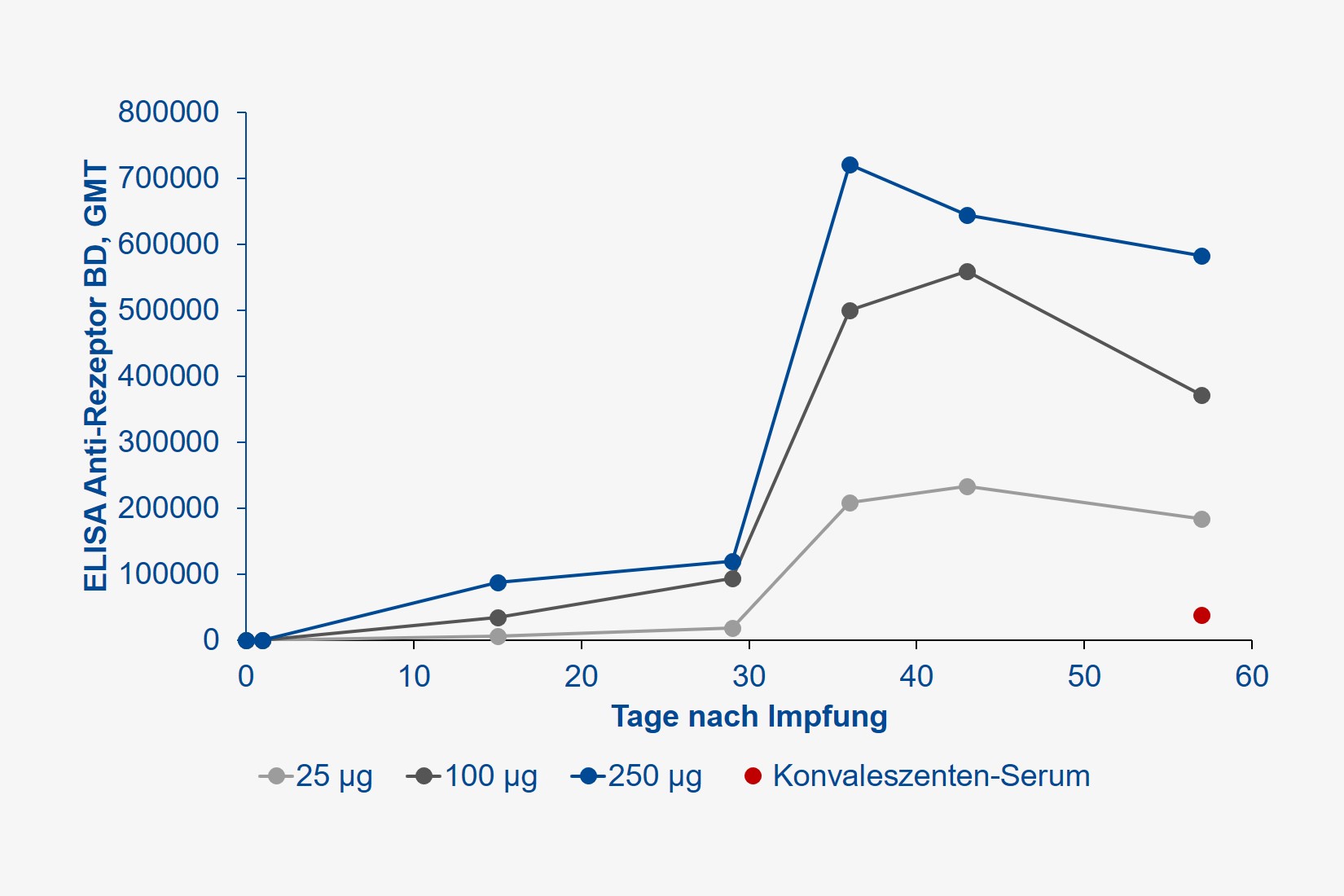
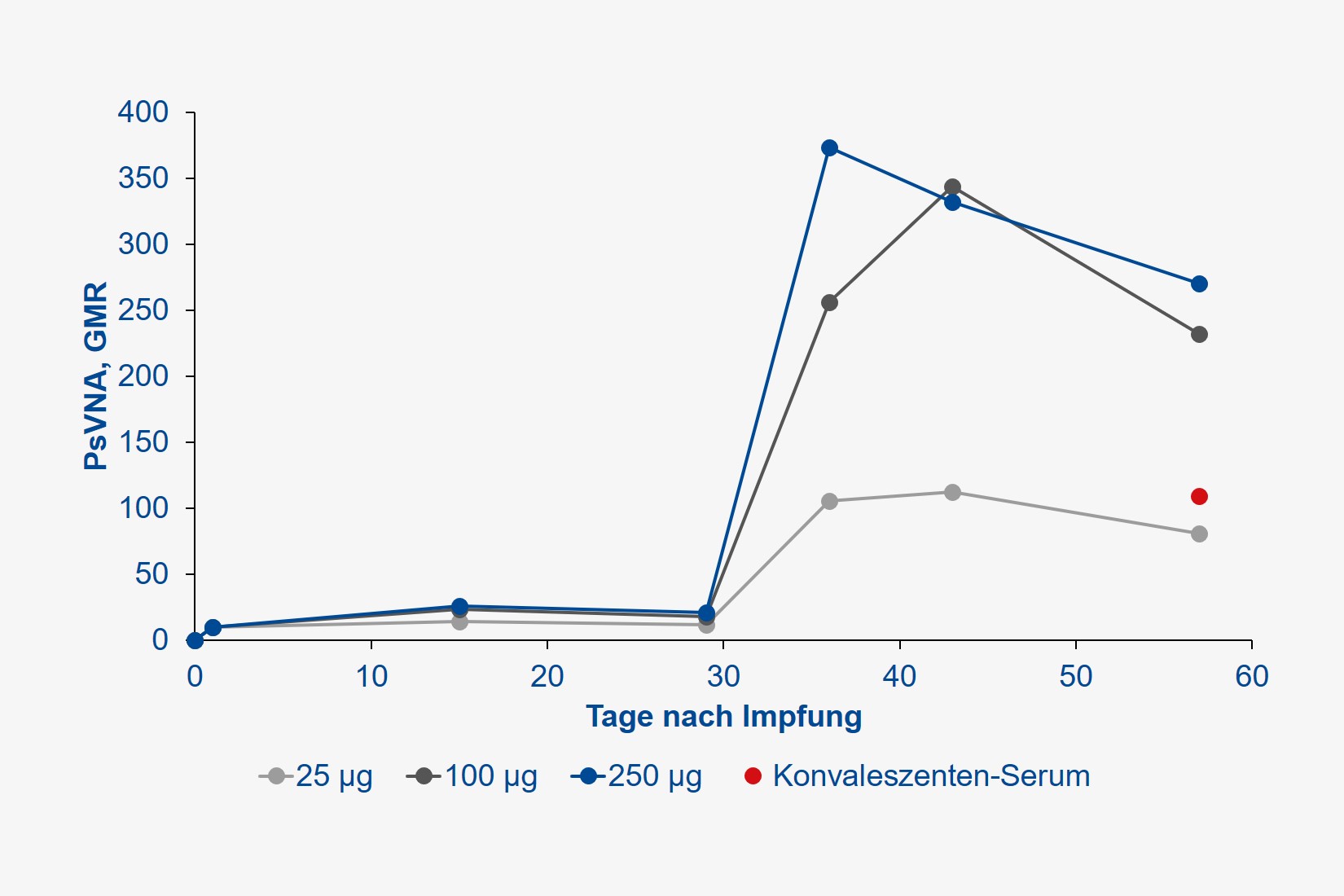
Es handelte sich um eine sogenannte Dosis-Eskalationsstudie, bei der je 15 gesunde Probandinnen und Probanden (23 Frauen, 22 Männer, mittleres Alter 33 Jahre) je zwei Injektionen (im Abstand von 28 Tagen) des mRNA-Impfstoffs in Dosierungen von 25, 100 oder 250 µg in die Oberarm-Muskulatur erhielten. Gemessen wurde die Antikörperbildung, sowohl gegen das Spike-Protein des SARS-CoV-2-Virus (wir berichteten), dessen Rezeptor-Bindungs-Domäne (also den hochspezifischen Schlüssel, welcher für den Eintritt in menschliche Zellen verantwortlich ist), aber auch die Produktion neutralisierender Antikörper, welche keine weiteren Immunmechanismen mehr erfordern, um das Virus zukünftig abwehren zu können.
Ein Großteil der Teilnehmenden berichtete sowohl nach der ersten als auch zweiten Injektion über bekannte Impfreaktionen wie lokale Schwellung, Müdigkeit o.Ä. Es traten aber keinerlei schwerwiegende unerwünschte Arzneimittelwirkungen auf.
Alle Teilnehmer entwickelten jedoch hohe Antikörper-Titer. Der Begriff Titer leitet sich aus dem Französischen „titre“ für „Feingehalt“ ab und bezeichnet das Flüssigkeitsvolumen, das einem in ihm gelösten biologischen Stoff gerade noch seine biologische Wirksamkeit erlaubt. Nehmen Sie an, Sie geben eine stark duftende Substanz in ein Schwimmbecken und füllen dieses solange mit Wasser auf, bis Sie keinen Geruch mehr wahrnehmen. So verhält es sich mit dem Nachweis von Antikörpern im Blut, je höher Sie dieses verdünnen können, der Antikörper aber immer noch ein Virus ausschalten kann, umso wirksamer ist dieser. Je höher also der Titer, umso effektiver der immunologische Schutz. Der Antikörper-Titer wird international als sogenanntes geometrisches Mittel (GMT) angegeben. Im Vergleich zum üblichen arithmetischen Mittel ist dieser Wert robuster gegenüber starken Schwankungen. Die Wirksamkeit neutralisierender Antikörper wird hingegen als „geometric mean response“ (GMR) bezeichnet, welche je nach Verdünnung imstande ist, 50 %, 80 % etc. aller Pathogene zu eliminieren. Gehen Sie der Einfachheit halber davon aus, dass eine Impfung umso wirksamer ist, je höher GMT und GMR, idealerweise über die Zeit sind.
Die durch die Impfung erzielten Antikörper-Konzentrationen wurden zudem mit denjenigen verglichen, die durch eine durchgemachte SARS-CoV-2-Infektion im Konvaleszenten-Plasma erzielt wurden. Die Ergebnisse sprechen für sich:
Fazit
mRNA-basierte Impfstoffe sind gut verträglich und führen nachweislich (insbsondere in hoher Dosis) zu einer Produktion von Antikörpern gegen das SARS-CoV-2-Spike-Protein sowie zu neutralisierender Antikörper-Aktivität. Wie lange diese nachweisbar sind bzw. anhält, muss die Nachbeobachtung zeigen. Der Hersteller Moderna hat angekündigt, die Phase-II-Sicherheitsdaten demnächst zu veröffentlichen und bereits eine große Phase-III-Studie mit zehntausenden Probandinnen und Probanden zu starten. Die US-amerikanischen Daten sind ein gutes Signal für die europäischen Bestrebungen um einen sicheren und effektiven Impfstoff gegen SARS-CoV-2.
Stand: 21.07.2020