Impfung mit inaktiviertem SARS-CoV-2-Virus
Viele erfolgreiche Impfstrategien (u.a. gegen Cholera, Tollwut und Polio) basieren auf inaktivierten Erregern („Totimpfstoffen“), den abgetöteten, nicht mehr vermehrungsfähigen Mikroorganismen.
Zahlreiche internationale Bemühungen um einen Impfstoff gegen SARS-CoV-2 stützen sich auf mRNA-Plattformen, bei denen die Virus-Erbinformation, die das Spike-Eiweiß codiert (Sie erinnern sich an das von uns wiederholt erläuterte „Schlüssel-Schloss-Prinzip“), in menschliche Zellen eingebracht wird, die dann dieses Merkmal auf ihrer Zelloberfläche zeigen („exprimieren“). Die Aufnahme der mRNA durch Zellen wird z.B. durch Verpackung in eine Art kleiner Fettpartikel („Liposomen“) erreicht.
Viele erfolgreiche Impfstrategien (u.a. gegen Cholera, Tollwut und Polio) basieren hingegen auf inaktivierten Erregern („Totimpfstoffen“), mit anderen Worten, den abgetöteten, nicht mehr vermehrungsfähigen Mikroorganismen. Dies gelingt bei Viren z.B., indem sie inaktivierenden chemischen Substanzen ausgesetzt werden, die zu einem Verlust der Infektiosität führen. Die entsprechend behandelten Viruspartikel können aber immer noch das menschliche Immunsystem zur Bildung von Antikörpern anregen.
Eine chinesische Forschergruppe der China National Biotec Group Company Limited, Peking, und der School of Public Health, Tongji Medical College, Huazhong, Wuhan, machten sich dieses Prinzip zu Nutze und führten zwei Placebo-kontrollierte Phase-I/II-Studien durch, um die Dosis, Sicherheit und Immunogenität dieses Impfstoffs zu prüfen. Die Ergebnisse wurden kürzlich im JAMA publiziert.
In der Phase-I-Studie erhielten je 24 gesunde Probandinnen und Probanden per Zufall 2,5, 5,0, 10,0 µg Antigen-Eiweiß oder als Placebo lediglich das dem Impfstoff beigefügte Aluminium-Hydroxyd-Adjuvans an drei Zeitpunkten (28 und 56 Tage nach der Erstgabe). Ein Adjuvans ist eine pharmakologisch nicht aktive Hilfssubstanz, welche die Wirkung eines Arzneimittels verstärken kann. In der Phase-II-Studie wurden 224 Teilnehmende in einem 3 : 1 Verhältnis per Zufall der Gabe von 5,0 µg oder Placebo sowie einer Zweitinjektion nach zwei oder drei Wochen zugeteilt.
Alle Teilnehmenden der Phase-I-Studie, welche die aktive Impfstoffkomponente erhielten, bildeten spezifische und neutralisierende Antikörper gegen SARS-CoV-2, unabhängig von der Dosis (Abbildung 1).
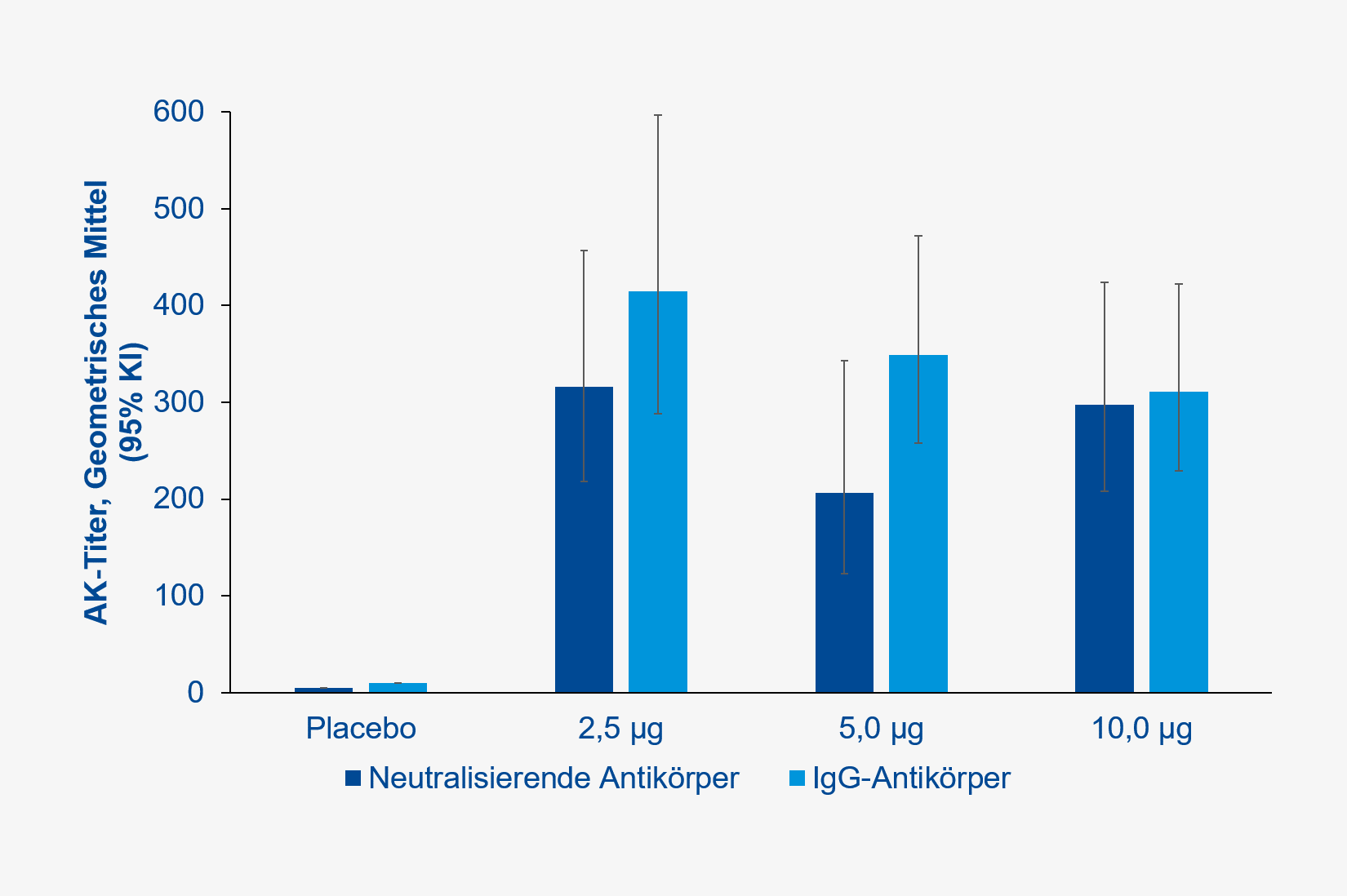
Abb. 1 Konzentration spezifischer und neutralisierender Antikörper gegen SARS-CoV2 in der Phase-I-Studie (gemäß publizierter Daten, JAMA)
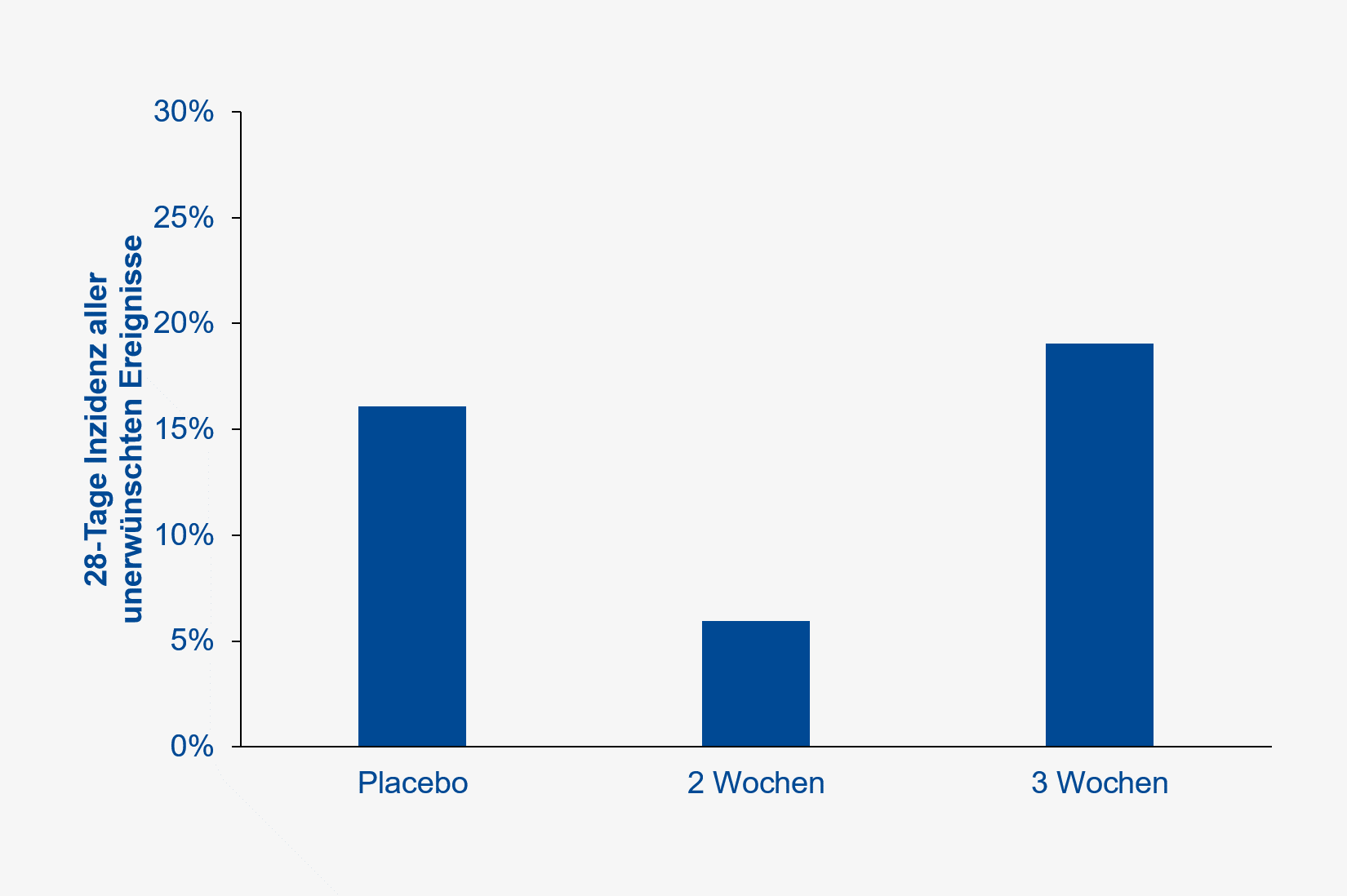
Die Häufigkeit aller unerwünschten Ereignisse betrug 3 / 24 (13 %) in der Placebo- und 15 / 72 (21 %) in der gesamten Impfstoff-Gruppe (nachberechnetes relatives Risiko [RR] 1,67, 95 % Konfidenzintervall [KI] 0,53 – 5,27, p=0,548) (Abbildung 2).
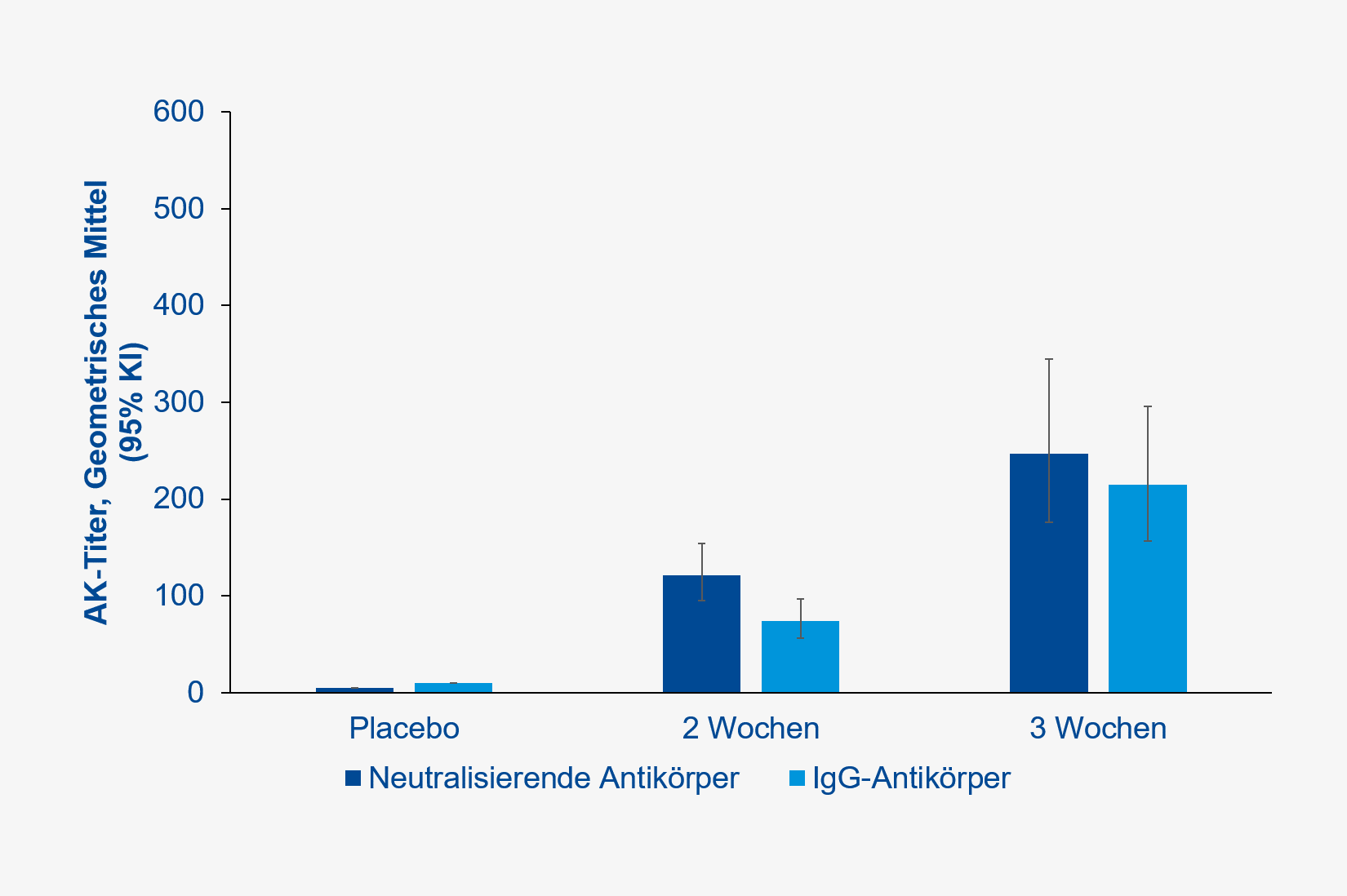
In der Phase-II-Studie zeigte sich eine deutlich höhere Antikörper-Antwort nach einer „Booster“-Impfung mit 5,0 µg, wenn diese nach drei Wochen statt nach zwei Wochen verabreicht wurde (Abbildung 3). Die Häufigkeit unerwünschter Ereignisse unterschied sich zwischen der Placebo- und 3-Wochen-Booster-Gruppe nicht (16 % versus 19 %, RR 1,19, 95 % KI 0,56 – 2,49, p=0,822)
(Abbildung 4).
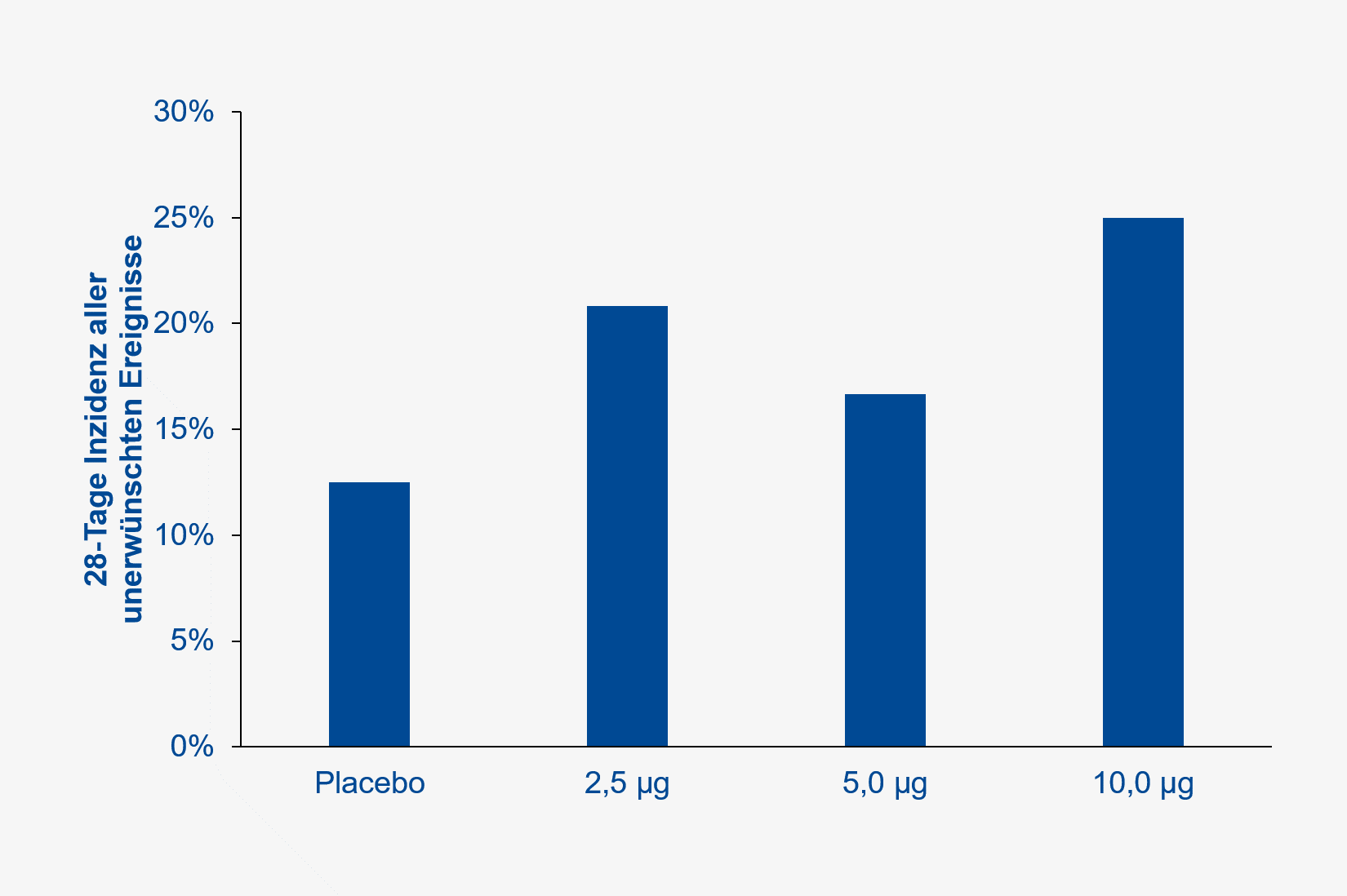
Abb. 2 Häufigkeit aller unerwünschten Ereignisse in der Phase-I-Studie (gemäß publizierter Daten, JAMA).
Fazit
Der chinesische Totimpfstoff führte in verschiedenen Konzentrationen und insbesondere nach einer „Booster“-Impfung drei Wochen nach der Erstgabe zu einer Produktion spezifischer und neutralisierender Antikörper gegen SARS-CoV-2. Etwa jede(r) fünfte Geimpfte zeigte lokale oder systemische unerwünschte Ereignisse. Weitere klinische Prüfungen müssen zeigen, ob Totimpfstoffe neben mRNA-Plattformen als primäre Präventionsstrategien in Frage kommen.
Stand: 11.09.2020