Impfstoff ChAdOx1 nCoV-19 (AZD1222)
Auch für den von der Universität Oxford in Zusammenarbeit mit AstraZeneca entwickelten Impfstoff ChAdOx1 nCoV-19 (AZD1222) wurden vielversprechende Zwischenanalysen laufender Phase-III-Studien veröffentlicht.
Im Gegensatz zum BNT162b2-Impfstoff nutzt ChAdOx1 nCoV-19 (AZD1222, häufig als „Oxford-Impfstoff“ bezeichnet) ein nicht vermehrungsfähiges Schimpansen-Adenovirus, um die genetische Information für das Spike-Oberflächenprotein des SARS-CoV-2-Virus in die menschliche Eiweißproduktionsmaschinerie einzuschleusen. Die Vakzine bedürfen zudem keiner Tiefkühlung bei -70°C. Dies bedeutet einen klaren logistischen Vorteil.
Aus insgesamt vier laufenden randomisierten Studien (COV001, COV002, COV003, COV005) in Brasilien, Südafrika und Großbritannien wurden Sicherheitsdaten gewonnen. Zur Wirksamkeitsanalyse trugen nur COV002 (Großbritannien) und COV003 (Brasilien) bei. Der Originalpublikation (The Lancet) wurde ein nahezu sechshundertseitiger elektronischer Anhang beigefügt.
Bemerkenswert ist, dass als Kontrolle ein Meningokokken-Impfstoff (MenACWY) verabreicht wurde, um insbesondere eine Verblindung im Hinblick auf lokale Impfreaktionen sicherzustellen.
In Großbritannien (COV002) erhielten etwa ein Drittel aller Teilnehmerinnen und Teilnehmer der AZD1222-Gruppe als erste Impfung eine Niedrigdosis (low dose, LD, 2,2 x 1010 Viruspartikel), als zweite Impfung nach drei Wochen die Standarddosis (SD, 5,0 x 1010 Viruspartikel). Die anderen zwei Drittel der AZD1222-Gruppe erhielten sowohl bei der ersten als auch zweiten Impfung die Standarddosis. Die erste Kohorte beinhaltete zudem ausschließlich Probandinnen und Probanden im Alter zwischen 18 und 55 Jahren, 90 % waren im Gesundheits- oder sozialen Sektor tätig. In der zweiten Kohorte waren 12 % bzw. 9 % aller Probandinnen und Probanden 56 bis 69 bzw. 70 Jahre und älter, etwa 60 % arbeiteten im Gesundheits- oder sozialen Sektor. In Brasilien (COV003) wiederum erhielten alle Teilnehmenden der AZD1222-Gruppe die Standarddosis, Kontroll-Probanden bei der ersten Impfung MenACWY, bei der zweiten Impfung ein Kochsalz-Placebo. Auch in der COV003-Studie waren knapp 90 % der Teilnehmenden im Gesundheits- oder sozialen Sektor beschäftigt.
Die Unterschiede im Versuchsaufbau und den Einschlusskriterien führten bereits im Vorfeld der Veröffentlichung zu einer lebhaften Debatte unter Wissenschaftlerinnen und Wissenschaftlern in den sozialen Netzwerken.
Die Vaccine Efficacy (VE, „Impfstoffwirksamkeit“) unter insgesamt 11.636 Teilnehmenden (5.807 AZD1222, 5.829 Kontrolle) wurde mit 70,4 % (95 % Konfidenzintervall [KI] 54,8 bis 80,6 %) berechnet. Aufgrund der geringen Infektionsraten innerhalb von knapp drei Monaten nach der zweiten Impfung (0,5 % AZD1222, 1,7 % Kontrolle) müssten theoretisch 83 Personen mit AZD1222 statt einer Kontrolle geimpft werden, um einen zusätzlichen COVID-19-Erkrankungsfall zu vermeiden.
Der unterschiedliche Versuchsaufbau führte zu einer hochinteressanten und für die zukünftige Impfstoffentwicklung eventuell bedeutsamen Beobachtung: Teilnehmerinnen und Teilnehmer der COV002-Studie in Großbritannien, welche eine Niedrigdosis gefolgt von der Standarddosis des Impfstoffs erhielten, zeigten eine höhere Impfstoffwirksamkeit (90,0 %) als diejenigen, welche zu beiden Impfterminen eine Standarddosis erhielten (60,3 %, Abbildungen 2 und 3). Eine mögliche Erklärung ist, dass bei erstmaliger Impfung der Standarddosis auch Antikörper gegen den Adenovirus-Vektor produziert werden und damit die Antikörper-Antwort nach der zweiten Booster-Impfung geringer ausfällt.
Etwas ungewöhnlich ist, dass sowohl im Hauptmanuskript als auch im elektronischen Anhang lediglich schwerwiegende unerwünschte Arzneimittelwirkungen (serious adverse events, SAE), nicht jedoch auch alle typischen Impfreaktionen berichtet werden. Die Häufigkeit von SAE betrug 84 bei 79 / 12.021 Teilnehmenden in der AZD1222- und 89 bei 91 / 11.724 Teilnehmenden in der Kontrollgruppe.
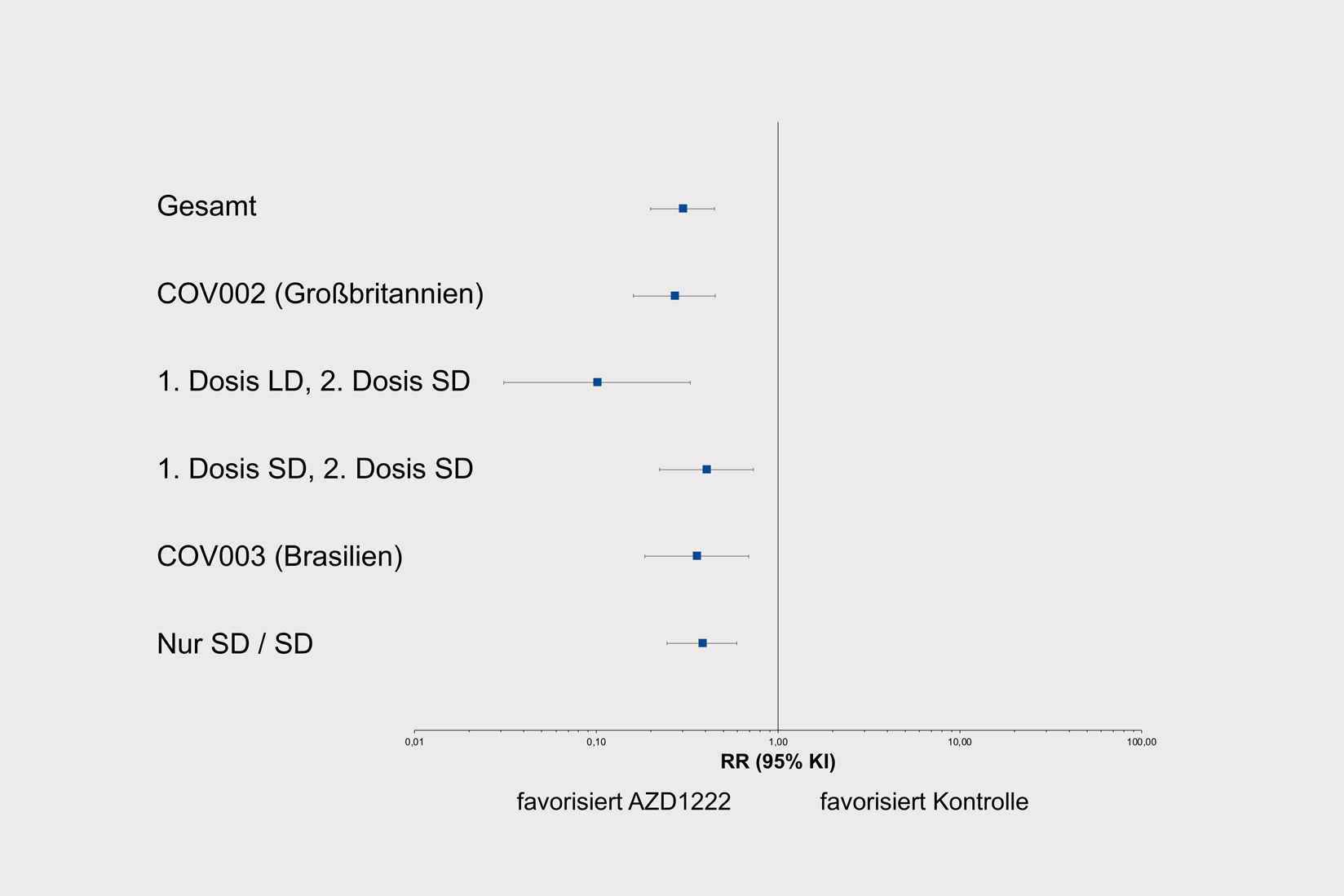
Abb.1
Relatives Risiko einer SARS-CoV-2-Infektion bzw. COVID-19-Erkrankung nach Impfung mit ChAdOx1 nCoV-19 (AZD1222) im Vergleich zu einer Kontrolle (MenACWY und / oder Kochsalz). Berechnet nach The Lancet.
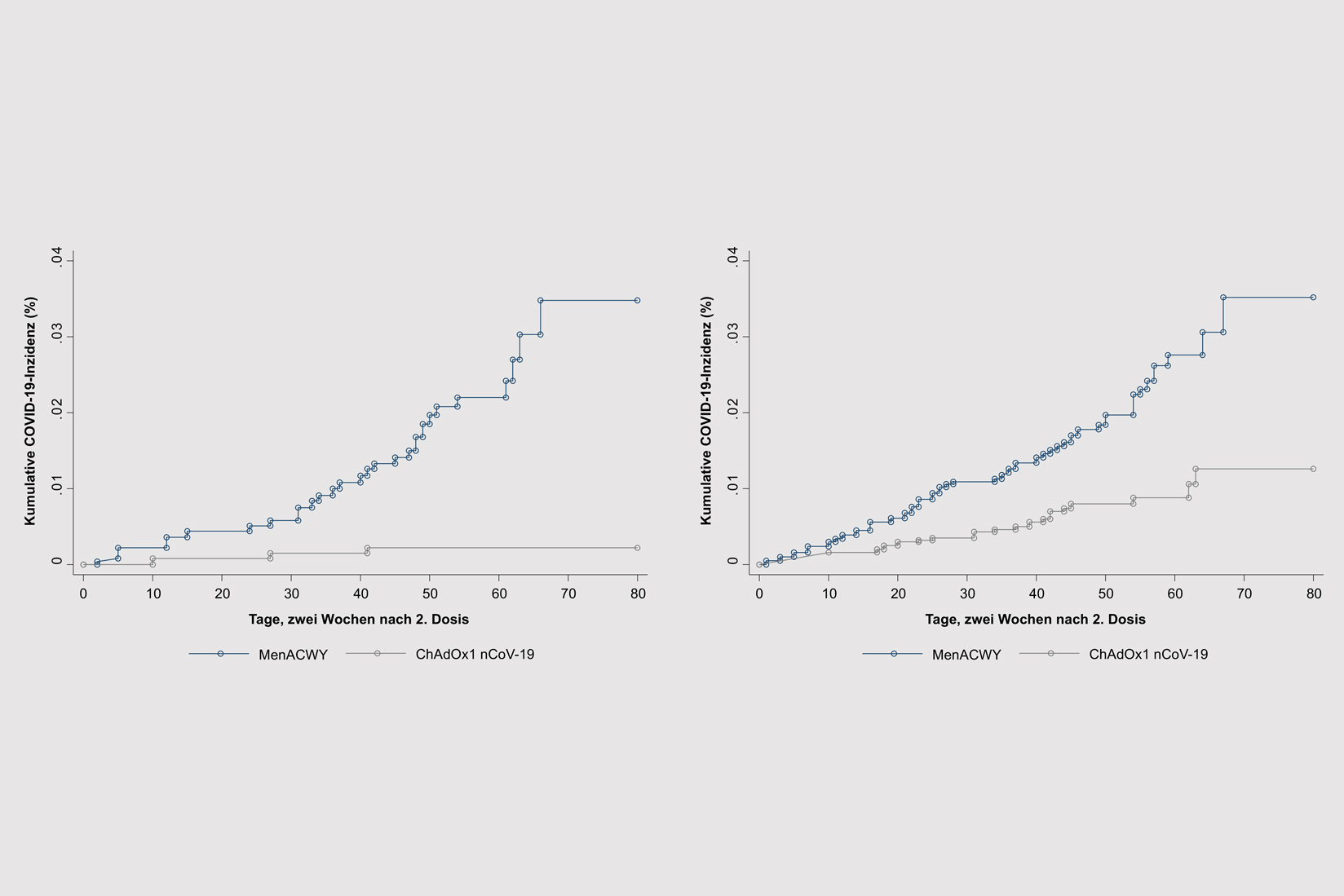
Abb.2/3
Kumulative Inzidenz einer SARS-CoV-2-Infektion bzw. COVID-19-Erkrankung nach Impfung mit ChAdOx1 nCoV-19 (AZD1222) im Vergleich zu einer Kontrolle (MenACWY und / oder Kochsalz). Links: 1. Impfung mit Niedrigdosis (LD), 2. Impfung mit Standarddosis (SD). Rechts: 1. und 2. Impfung mit Standarddosis (SD). Berechnet nach The Lancet.
Fazit
Das sogenannte „Oxford-Vakzine“ (ChAdOx1 nCoV-19, AZD1222) wird voraussichtlich der nächste Impfstoff sein, der nach BNT162b2 die regulatorische Freigabe für Massenimpfungen in der EU erhalten wird. Da keine Tiefkühlung bei -70°C erforderlich ist, bietet der Oxford- / AstraZeneca - Impfstoff logistische Vorteile gegenüber dem Produkt von BioNTech / Pfizer. Die Hersteller müssen sich zur optimalen Dosierung positionieren. Die verfügbaren Daten legen nahe, dass zunächst eine Niedrigdosis, gefolgt von einer Standarddosis nach drei Wochen geimpft werden sollte. Auch das Spektrum unerwünschter Arzneimittelwirkungen sollte noch transparenter dargestellt werden.
(Stand: 17.12.2020)