Remdesivir 3
Erste Ergebnisse der unter Federführung des National Institute of Allergy and Infectious Diseases (NIAID) der US-amerikanischen National Institutes of Health (NIH) durchgeführten multinationalen Studie zur Wirksamkeit des Ebola-Medikaments Remdesivir bei COVID-19 gingen bereits durch die Presse. Sowohl die Food and Drug Administration (FDA) als auch die europäische Arzneimittelagentur (EMA) erweiterten auf dieser Grundlage die Anwendung der Substanz in der besonderen klinischen Ausnahmesituation.
Umfangreichere, aber immer noch vorläufige Daten der noch laufenden Studie wurden nun im New England Journal of Medicine veröffentlicht.
In das Adaptive Covid-19 Treatment Trial (ACCT-1) wurden zwischen dem 21. Februar und 19. April 2020 an 60 Kliniken weltweit (in Deutschland: Universitätskliniken Bonn, Frankfurt am Main und Köln) aufgrund von COVID-19 stationär behandelte Patientinnen und Patienten mit Zeichen einer Beteiligung der unteren Atemwege eingeschlossen. Diese erhielten per Zufall (Randomisierung) entweder den Therapiestandard plus Remdesivir intravenös (200 mg an Tag 1, gefolgt von 100 mg von Tag 2 bis 10) oder den Therapiestandard plus einer intravenösen Kochsalzinfusion (Placebo) an gleichen Tagen. Das primäre Studienziel war die Zeit bis zur Genesung, definiert als klinischer Zustand, der entweder der Kategorie 1 (nicht hospitalisiert, keine Einschränkungen), 2 (nicht hospitalisiert, mit Einschränkungen und / oder häuslicher Sauerstoffgabe, oder 3 (hospitalisiert, kein Sauerstoff-- oder Pflegebedarf) entsprach.
Von 1.107 erfassten Patientinnen und Patienten konnten 1.063 randomisiert (379 Frauen, 684 Männer, mittleres Alter 59 [SD 15] Jahre, 50% mit arteriellem Hypertonus, 37% mit Adipositas und 30% mit Diabetes mellitus) und 1.059 ausgewertet werden. Die weitaus meisten Teilnehmer stammten aus Nordamerika (80%), gefolgt von Europa (15%) und Asien (5%).
Bis zum 29. Tag nach Therapieeinleitung waren 334 von 538 (62%) Teilnehmer in der Remdesivir- und 273 von 521 (52%) Teilnehmern in der Placebo-Gruppe genesen. Die Differenz von 10% zugunsten des Ebola-Medikaments Remdesivir war nicht allein mit dem Zufall vereinbar. Würde man das Experiment 100 Mal wiederholen, würde Remdesivir in 95 Fällen zwischen 4 und 16% mehr Genesungen von COVID-19 bedingen als eine Standardbehandlung allein.
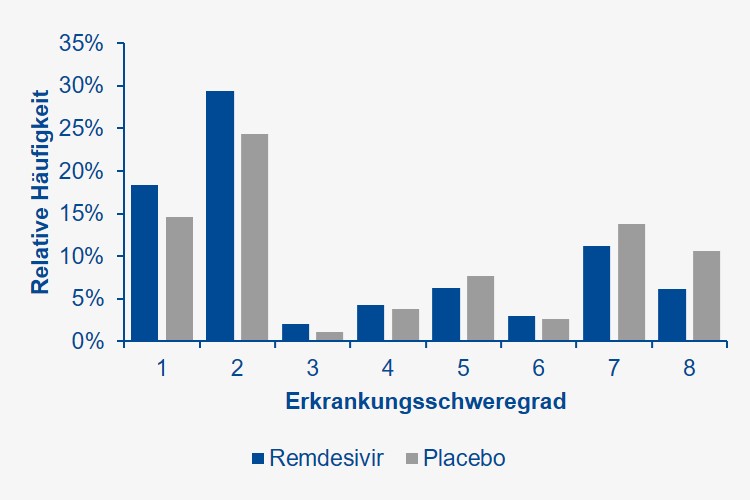
Die Sterblichkeit nach zwei Wochen wurde durch Remdesivir von 54 / 521 (10%) auf 32 / 538 (6%) reduziert. Auch diese Differenz war kein reines Zufallsprodukt. Würde man das Experiment 100 Mal wiederholen, würde Remdesivir in 95 Fällen die Sterblichkeit an COVID-19 zwischen 1 und 8% im Vergleich zu einer Standardbehandlung allein senken. Etwa jeder 10. bzw. 25. COVID-19-Kranke würde im Hinblick auf (raschere) Genesung und Überleben von einer Remdesivir-Therapie profitieren. Abbildung 1 zeigt die relative Häufigkeit (prozentuale Verteilung) der klinischen Zustandsbeschreibungen von 1 (nicht hospitalisiert, keine Einschränkung) bis 7 (maschinell beatmet bzw. unter ECMO) oder 8 (verstorben) an Tag 15 unter Remdesivir bzw. Placebo. Der stärkste Effekt von Remdesivir wurde bei COVID-19-Erkrankten beobachtet, die nach stationärer Aufnahme zwar zusätzlich O2, jedoch keine weitere Atemunterstützung benötigten (etwa 40% aller Studienteilnehmer).
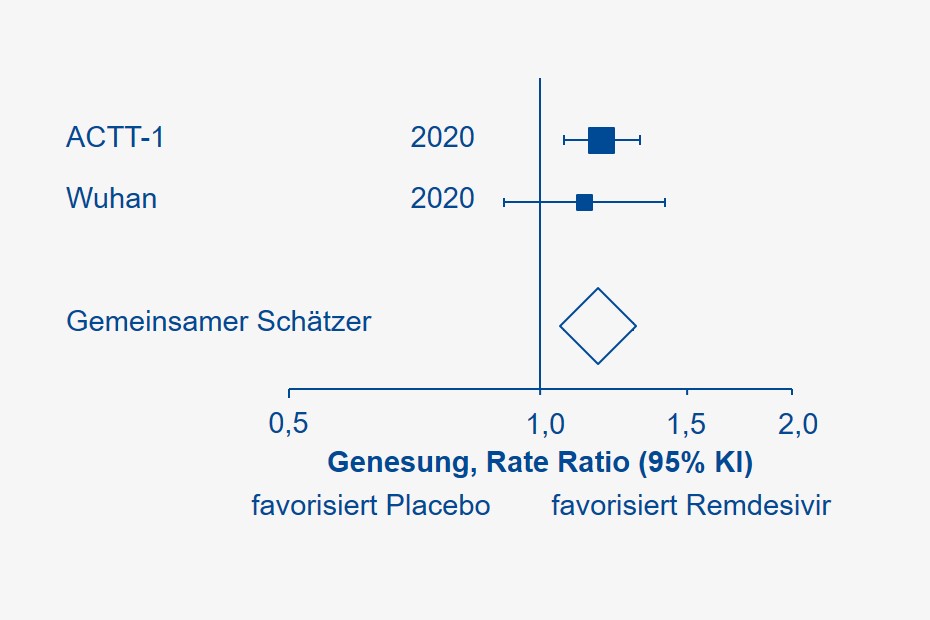
In einem früheren Newsletter hatten wir bereits die Ergebnisse der ersten randomisierten Studie zu Remdesivir aus Wuhan, China, illustriert. Während sich Alter und Geschlechtsverteilung zwischen dieser und der aktuellen Untersuchung ähnelten, waren ein Viertel aller ACCT-1-Probanden bereits bei Klinikaufnahme auf eine maschinelle Beatmung oder ECMO angewiesen (in der chinesischen Studie betraf dies lediglich einen Teilnehmer). Dennoch deuten beide Studien auf einen Vorteil der intravenösen Remdesivir-Gabe bezüglich der Genesungsraten hin. Fasst man beide Studien (mit aller Zurückhaltung) mittels statistischer Methoden (Meta-Analyse) zusammen, liegt die realistische Rate Ratio einer Genesung bei 1,18 (95% Konfidenzintervall 1,07 – 1,29), oder, relativ betrachtet, in 95 von 100 Experimenten bei 7 bis 29% zugunsten des Ebola-Medikaments im Vergleich zu bisherigen Therapiestandards.
Die publizierten Ergebnisse sind immer noch vorläufig. Keine Wirkung ohne Nebenwirkung - es muss sich insbesondere zeigen, mit welchen unerwünschten Ereignissen der mäßige Vorteil von Remdesivir erkauft wird (die bisherigen Informationen legen allerdings kein erhöhtes Risiko nahe). Die deutschen Studienpartner sind angehalten, so rasch wie durch das internationale Konsortium und Embargo gestattet, die Behandlungsergebnisse der deutschen Stichprobe offen zu legen, auch wenn diese sicher begrenzt sein dürfte. Die Häufigkeit und der etwaige Effekt einer Co-Therapie mit Hydroxychloroquin, Azithromycin u.a. gängiger Medikamente wurde ebenfalls nicht beschrieben und muss in weiteren Publikationen berücksichtigt werden.
Fazit
Das Ebola-Medikament Remdesivir stellt die bisher erste, wissenschaftlich belastbare Therapieoption bei COVID-19 mit mäßigen günstigen Effekten auf die Zeit bis bzw. die Häufigkeit einer Genesung sowie die Sterblichkeit dar. Etwa jede(r) 10. Behandelte könnte von einer Remdesivir-Therapie profitieren. Sowohl die endgültigen und Langzeitergebnisse der ACCT-1-Studie als auch die Resultate weiterer laufender Untersuchungen müssen berücksichtigt werden, um den Nutzen des Medikaments unter dieser Indikation beurteilen zu können.
Stand: 26.05.2020